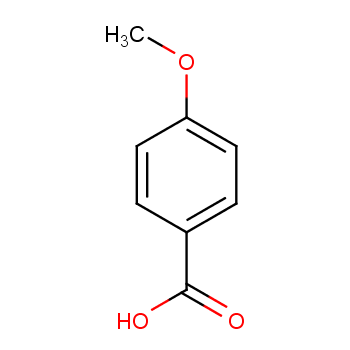
药用级甲基二磺酸作为符合医药行业质量标准的关键精细化学品,在药物研发、制剂生产及医药中间体合成领域具有特定应用价值,其产品特性严格遵循药用辅料或药用中间体相关规范,具体信息如下:
- 外观性状:通常为白色至类白色结晶性粉末或片状固体,无明显异味,杂质含量极低,无肉眼可见异物,确保在药物体系中不引入外观瑕疵。
- 熔点:96-100℃(药用级产品熔点范围更窄,通常波动不超过 ±1℃,纯度越高熔点越接近理论值,可作为纯度判断辅助指标)。
- 沸点:263℃(101.3kPa,常压下稳定,高温下需避免剧烈加热以防分解)。
- 密度:约 1.65 g/cm3(25℃,固体状态下密度稳定,便于制剂配方中精准计量)。
- 溶解性:易溶于水(25℃时溶解度约 2458g/L),可溶于甲醇、乙醇等药用溶剂,微溶于 DMSO,溶解后溶液澄清透明,无浑浊或沉淀,符合药用制剂对溶剂相容性的要求。
- 酸度:1g/L 水溶液在 23.9℃时 pH 值约为 - 0.96,pKa 约为 - 0.71±0.50,属于强酸性物质,在药用场景中需注意与其他成分的酸碱配伍稳定性。
药用级产品区别于工业级的核心在于严格的杂质控制和安全性要求,关键质量指标需满足以下要求(具体以对应药典标准为准):
- 纯度:甲基二磺酸含量≥99.0%(通常采用高效液相色谱法 HPLC 或滴定法检测,确保主成分含量达标,减少杂质干扰)。
- 重金属限量:铅(Pb)≤0.0005%、汞(Hg)≤0.0001%、砷(As)≤0.0001%、镉(Cd)≤0.0001% 等,通过原子吸收光谱法或电感耦合等离子体质谱法(ICP-MS)检测,避免重金属对人体的潜在毒性。
- 炽灼残渣:≤0.1%(经高温炽灼后残留的无机杂质含量极低,确保不引入无机污染物)。
- 水分:≤0.5%(采用卡尔?费休法检测,控制水分含量以避免产品吸潮结块,同时保证在制剂储存过程中的稳定性)。
- 有关物质:需控制原料残留(如合成过程中可能产生的磺酸类杂质、甲基磺酸等)及降解产物的含量,单个杂质≤0.1%,总杂质≤0.5%(通过 HPLC 法分离检测,确保无有毒有害杂质)。
- 微生物限度:若用于口服或外用制剂,需符合药用辅料微生物限度标准,如细菌总数≤100 CFU/g、霉菌和酵母菌总数≤10 CFU/g,不得检出大肠杆菌、金黄色葡萄球菌等致病菌(通过微生物培养法检测,避免微生物污染引发的用药安全风险)。
- 稳定性:在常温、干燥、密封条件下储存时稳定性良好,不易分解;但具有吸湿性,需防潮储存,避免因吸潮导致含量变化或结块;与强碱、强氧化剂接触可能发生反应,在制剂配方设计中需避开此类配伍,同时避免长期高温(超过 150℃)环境以防分解产生有害气体。
- 反应性:作为二元强磺酸,可参与酯化、磺化等化学反应,在药用中间体合成中可作为酸性催化剂或磺化试剂,其反应产物需符合药用纯度要求,且自身无明显药理活性,不干扰主药的。
药用级甲基二磺酸主要作为药用辅料或医药中间体使用,具体场景包括:
- 药物合成中间体:用于合成某些含磺酸基团的药物分子,作为磺化反应的原料或催化剂,其高纯度可确保最终药物产品的质量和安全性。
- 制剂 pH 调节剂:在部分液体制剂(如注射剂、口服溶液)中,可作为酸性 pH 调节剂,精准调节药液 pH 值至适宜范围,提升主药的溶解度、稳定性或生物利用度(需严格控制用量,避免酸性过强对黏膜的刺激)。
- 药用催化剂:在某些药物的合成工艺中,作为高效、低毒的酸性催化剂,替代传统强酸(如硫酸),减少副反应产生,降低产品杂质含量,符合绿色制药工艺要求。
- 包装规格:采用药用级包装材料,常见规格为 1kg / 铝塑复合袋、5kg / 纸桶(内衬药用聚乙烯袋)、25kg / 纸板桶(内衬双层药用聚乙烯袋),包装材料需符合《药用包装材料标准》,具有良好的密封性和阻隔性,防止产品吸潮、污染或泄漏。
- 储存条件:应储存于阴凉干燥处(温度 10-30℃,相对湿度≤60%),密封、避光、远离热源及强氧化剂、强碱类物质;储存过程中需定期检查包装完整性,防止吸潮结块。
- 运输要求:运输过程中需轻装轻卸,避免包装破损;严禁与有毒、有害、有污染的物品混运;运输环境需符合常温、防潮要求,避免暴晒或雨淋。
- 药用级产品虽经过严格纯化,但仍属于强酸性物质,操作人员需佩戴耐酸手套、防护眼镜及防护服,避免直接接触皮肤、黏膜或吸入粉尘,若不慎接触,需立即用大量清水冲洗,必要时就医。
- 作为药用辅料或中间体,需严格按照药品生产质量管理规范(GMP)要求使用,确保生产环境洁净度,避免交叉污染。
- 产品需在有效期内使用,过期后需重新检测质量指标,确认合格后方可继续使用。
以上描述充分体现药用级甲基二磺酸的质量规范性、应用安全性及药用场景适配性,可作为医药行业采购、研发及生产过程中的参考依据。